糖尿病の治療薬一覧
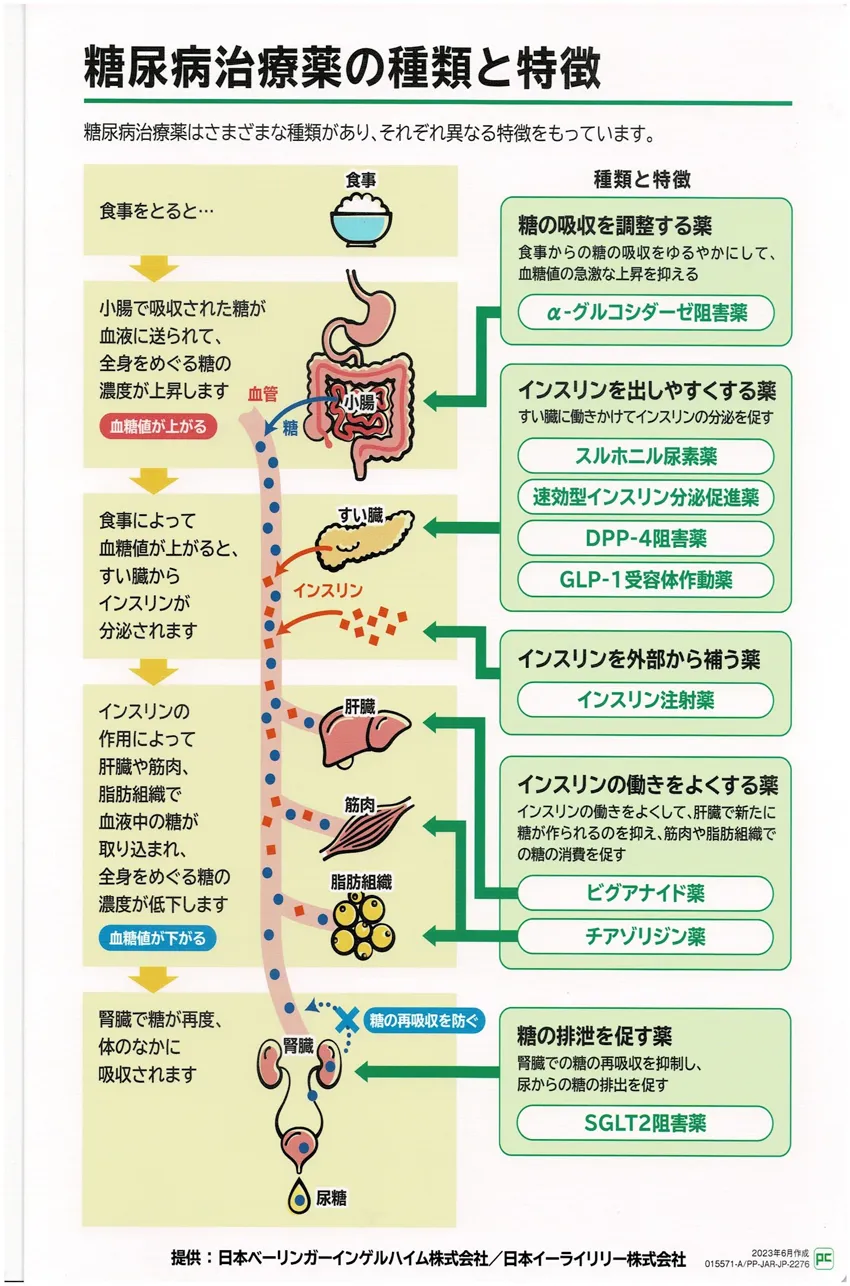
糖尿病の薬の使い方
- 糖尿病昏睡、重篤な肝障害・腎障害・感染症、妊娠はインスリン製剤一択
- 1型糖尿病は基本インスリン製剤、効果不十分の場合、SGLT2阻害薬(適応のあるもの)の追加は可能、食後血糖高い場合αGI追加できる。チアゾリジン、ビグアナイド、イメグリミン、DPP4阻害薬、GLP-1、GLP-1配合の注射は2型のみの適応。
- 食事・運動療法で効果が見られないor効果が見られても診断基準を大きく上回っている場合薬物療法へ
- 2型糖尿病は、ビグアナイドが第一選択、そしてDPP4、GLP-1、SGLT2阻害薬が第二選択、ダメなら、インスリン、SU剤で、チアゾリジンはガイドラインから削除された。
- DPP4阻害薬とGLP-1作動薬の併用、グリニドとSU剤との併用は保険出来られるので注意する。
- 肥満(BMI25以上)か非肥満かに分類する。(BMI:体重kg/身長m*身長m)
- 肥満(インスリン抵抗性)の人には、第一選択としてビグアナイド(メトホルミン)かチアゾリジン(アクトス)。膀胱がんを気にするならビグアナイド
- 非肥満の人には、ビグアナイド(メトホルミン)が第一選択。ただし、75歳以上の高齢者や腎機能が弱い人にはDPP4阻害薬が推奨される。
- 食後2h血糖値が高い場合は、αGIかグリニド製剤が第一選択
- SU剤は、上記3パターンのうちで、非肥満、A1cがすごく高値、メトホルミンが使用できない場合に限定して使用すると良い(SU剤は最初の2年は下がるがその後は上がる=一時的な効果しか持たないため)。SU剤でないと効かない人は全体の1割程度。
- SUは朝飲むと次の日の夜間に低血糖(寝ている間に低血糖になっている)が起きることが多い(CGM:持続血糖測定器にて)。そのため、SU剤投与でA1cが下がっていたとしても低血糖時を含めた変動幅が多い血糖コントロールであることが多いため注意する。A1cを漠然と下げることよりも、血糖の変動幅を狭くする(上は180~200、下は70以上。70未満は低血糖症状出る。)ことに重点を置く。低血糖の起きているA1c6.5%と低血糖が起きていない7.0%なら、心血管イベントの発生率は前者のほうが高い。低血糖の抑制は心血管イベントの抑制につながり、認知症の予防にもつながるため、A1cを低くしすぎても低血糖になるのはダメ。CGMを用いずに夜間低血糖が起きているかどうかを知るには体重が増加してA1cが下がっているのであれば注意ということ。
- A1cの治療目標三段階の6%未満は低血糖が起きていないこと人だけが目指せる基準。A1c8%以上の人の低血糖発現率は5%未満だが、8%以下になると50%以上の人が低血糖を起こしている。
- SU剤は、虚血プレコンディショニングとEpac2刺激の観点から、グリミクロンとアマリールが勧められている(ほかは非推奨)。
- 薬物治療でもHbAicが8%~10%以上になってしまっている場合にインスリンの適応となる。8%台あたりから使用したほうが予後が良い。
関連ページ
コメントor補足情報orご指摘あればをお願いします。



